S-8 : NiO = Ni(s) + 1/2O2(g)의 산소분압?
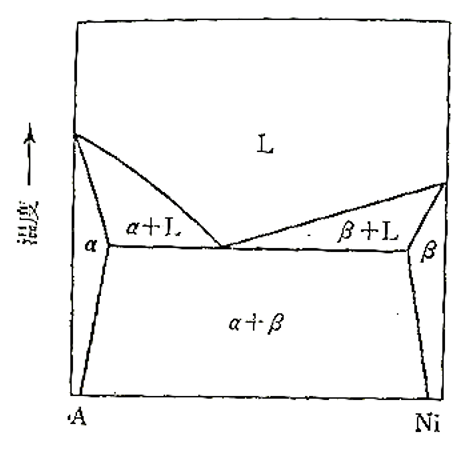
S-8 : Ni과 A원소는 그림 3-1에 보인 것 같은 상태도를 나타낸다.
1000K에서는 A원소는 Ni을 4at% 용해하고, Ni은 A원소를 6at%용해한다.
이 때 A원소중에 1at%용해되어 있는 Ni이 산화하여 NiO로되는 산소압을 구하시오.
단, A 원소는 Ni보다도 안정하고, 높은 산소압에서 산화되기 쉬운 것으로 가정한다.
또한, Ni의 표준생성자유에너지는 다음과 같다.
NiO = Ni(s) + 1/2O2(g) ΔG1000° = 34900㎈
풀이)
NiO = Ni(s) + 1/2O2(g) ΔG° = ΔH° - TΔS° ----(1)
ΔG° = (1) = 34900㎈ (at 1000°)
ΔG° = -RT lnK -----(2)
(1) = (2) 이므로
34900 = -RT lnK
ln K = 34900/(-RT)

여기서 a_NiO = 1 이다.
A원소에 1at%Ni가 용해한 용체중에 Ni의 활량은 다음과 같이 구할 수 있다.
Ni의 1차 고용체 β에서는
Ni는 라울(Raoult)의 법칙에 따른다.
용해도 곡선상에 N_Ni = 0.94에서는 a_Ni = 0.94이 된다.
이 상(相, Phase)은 Ni를 4% 포함하는 A의 1차 고용체 α와 평행하고 있기 때문에
N_Ni = 0.04에서는 a_Ni =0.94이다. 이 Ni는 핸리(Henry)의 법칙을 따르기 때문에 γ_Ni는 일정하기 때문에
a_Ni = γ_Ni • N_Ni 에 의해

1at%Ni 용체중의 Ni의 활량은
a_Ni = 0.01 x 23.5 = 0.235
식(1)에 의해
0.235 x P_O2^(1/2) = 2.36 x 10^-8
= 1 x 10^-14atm